Структура приказа: Приказы по основной деятельности
Виды и структура приказов — Мегаобучалка
Характеристика приказов
Приказы, органы центрального и местного управления в России середины 16- середины 18 веков. Слово «приказ» в смысле особое поручениевошло в обращение с середины 16 века.
Зарождение приказной системы происходило в конце 15- начале 16 веков. Она сложилась
в ходе преобразований середины 16 века. В это время начали функционировать приказы:
Большого дворца (1534), Большого прихода (1554), Земский (1564), Казанский (1560-е годы), Казенный (1512), Костромской четверти (1560-е годы), Ловчий (1509), овгородской четверти (1560-е годы), Оружейной палаты (первая половина 16 века), Печатный (1553), Полоняничный (середина 16 века), Посольский (1549), Разрядный (первая половина 16 века), Сокольничий (1550), Стрелецкий (1571), Устюжской четверти (1560-е годы), Холопий (середина 16 века), Челобитный (середина 16 века), Ямской (1550).
Военные
реформы привели к созданию Разрядного приказа, ведавшего личным составом
и службой поместного войска, и Поместного приказа, которому было поручено
обеспечение служивших помещиков землей. Стрелецкий приказ ведал стрелецким войском. Перестройка системы «ямской гоньбы» (службы связи) привела к возникновению Ямского приказа. Введение губных учреждений на местах вызвало организацию Разбойного приказа. Расширение международных связей способствовало становлению самостоятельного Посольского приказа. Следствием разобщенности отдельных земель, вошедших в состав единого Русского государства, стало создание
Стрелецкий приказ ведал стрелецким войском. Перестройка системы «ямской гоньбы» (службы связи) привела к возникновению Ямского приказа. Введение губных учреждений на местах вызвало организацию Разбойного приказа. Расширение международных связей способствовало становлению самостоятельного Посольского приказа. Следствием разобщенности отдельных земель, вошедших в состав единого Русского государства, стало создание
наряду с общегосударственным финансовым Приказом Большого прихода территориальных судебно-административно финансовых четвертей (Чети), а также специальных судебных региональных приказов. Расширение границ на юго-восток обусловило появление Приказа Казанского дворца. Приказами называли не только центральные учреждения,
но и некоторые местные дворцовые учреждения, например, возникшие в 1620-х годах Новгородский и Псковский дворцовые приказы, находившиеся в ведении Приказа Большой казны. Название «приказ» употреблялось и для обозначения стрелецких полков. Приказы были постоянно действующими учреждениями и в основу их деятельности был положен функциональный принцип. Каждый приказ ведал определенным кругом вопросов, имел самостоятельный штат. Для многих приказов было характерно совмещение судебных, административных и финансовых функций, соединение функционального управления с территориальным.
Каждый приказ ведал определенным кругом вопросов, имел самостоятельный штат. Для многих приказов было характерно совмещение судебных, административных и финансовых функций, соединение функционального управления с территориальным.
Приказы находились в непосредственном ведении царя и Боярской думы. Главы приказов получили в 17 веке название судей, так как зачастую выполняли судебные функции. В 16 веке среди них преобладали дьяки, в 17 веке некоторые крупные приказы возглавляли бояре и окольничие, более мелкие -думные дворяне. Однако и в 17 веке дьяки руководили рядом важных приказов
(Разрядным Посольским, Поместным). Приказное делопроизводство велось дьяками и подъячими.
Численность персонала приказов (приказных людей) колебалась от 3 до 400 человек.
С начала 17 века в приказах появляется внутреннее структурное деление. В 1613-1619 годах было организовано одиннадцать новых приказов. В области военного управления были созданы приказы: Казачий, Иноземский, Рейтарский, Городового дела; в области финансов начали действовать
приказы Новой четверти и Большой казны, полномочия территориальных четвертей были расширены. В первой половине 17 века создавались временные приказы, которые, выполнив поставленные перед ними задачи, прекращали существование. В военное время возникали приказы Сбора ратных и даточных людей, Денежного и хлебного сбора, Сбора пятинных и запросных денег. Временный характер носили многочисленные сыскные приказы. К середине 17 века насчитывалось
В первой половине 17 века создавались временные приказы, которые, выполнив поставленные перед ними задачи, прекращали существование. В военное время возникали приказы Сбора ратных и даточных людей, Денежного и хлебного сбора, Сбора пятинных и запросных денег. Временный характер носили многочисленные сыскные приказы. К середине 17 века насчитывалось
около восьмидесяти приказов.
В 1650-1660-х годах правительство пыталось перестроить работу центральных учреждений. Были предприняты попытки централизации управления путем объединения руководства нескольких приказов в одних руках, созданы приказы Тайных дел и Счетный, осуществлявшие контроль за деятельностью остальных приказов и подчинявшиеся непосредственно царю. Но существование их было непродолжительным. В 1680-х годах правительство провело новую реформу приказной системы, ставившую своей целью концентрацию однородных функций управления в одном ведомстве. Большинство четвертей вошли в состав Посольского приказа, на базе Приказа
Большой казны было создано крупное финансовое учреждение, в котором слились приказы
Большого прихода и Новой четверти. Приказу Большой казны были переданы финансовые
Приказу Большой казны были переданы финансовые
функции четвертей. Ликвидация приказной системы происходила в начале 18 века во
время петровской реформы аппарата управления и введения коллегий. Лишь немногие из
приказов продолжали функционировать и позднее. Сибирский приказ сохранился до 1763 года.
Виды и структура приказов
На XVII в. приходится расцвет приказов как органов центрального государственного управления. Общегосударственные приказы, подразделявшиеся на административные , судебно-полицейские, областные (территориальные), военные и финансовые составляли самую большую группу в подчинении Боярской думы. Дворцовые приказы, которые подчинялись царю и осуществляли управление землями, крестьянами, дворцами, мастерскими и т.д. К третьей группе относились патриаршие приказы, управлявшие патриаршим имуществом, а также вершившие суд по преступлениям против веры. Особое место в системе занимал Приказ Тайных дел, образованный в 1654 г. Он являлся личной канцелярией царя Алексея Михайловича, контролировал деятельность других приказов. Там решались важнейшие государственные вопросы, без согласования с Боярской
Он являлся личной канцелярией царя Алексея Михайловича, контролировал деятельность других приказов. Там решались важнейшие государственные вопросы, без согласования с Боярской
думой. Формы контроля были самыми разнообразными: изучение дел, сведений и отчетности приказов, рассмотрение челобитных, поданных лично царю; посылка подьячих с секретным наказом
для проверки деятельности приказных и воевод. Ведал также политическим сыском. Среди рассмотренных им политических дел: такие как дела патриарха Никона и Степана Разина. Приказ Тайных дел помещался во дворце, и царь часто бывал там, принимая участие в составлении бумаг;
требовал отчетов, слушал доклады, отдавал распоряжения. Упразднили Приказ тайных дел в 1676 г. после смерти Алексея Михайловича.
Характерным недостатком приказной системы управления являлась пестрота и неопределенность функций приказов, отсутствие четкого разграничения компетенций
между приказами. За все время существования приказной системы акт, регламентировавший
организацию и порядок деятельности приказов в общегосударственном масштабе, так и
не был подготовлен и издан. Путаница была во всем: во главе приказа стоял судья,
Путаница была во всем: во главе приказа стоял судья,
но иногда судью приказа именовали по-другому: казначей, печатник, дворецкий, оружничный
и т.д. Судьи приказов назначались из членов Боярской думы: бояр, окольничих, думных
дворян и думных дьяков, но было и такое, что один и тот же судья одновременно возглавляло несколько приказов.
Обширное бумажное делопроизводство востребовало людей, обладающих опытом
канцелярской работы. Судьи приказов такого опыта иногда не имели, им в помощники
назначались дьяки, число которых зависело от значения приказа. Дьяки комплектовались
из родового дворянства, они фактически и вершили дела в приказах. За свою службу они награждались поместным окладом и получали денежное вознаграждение. У дьяков в подчинении находились канцелярские служители – подьячие. Начинающий подьячий несколько лет служил «неверстанно», т.е. без жалованья, на одни «приношения» просителей. Затем его награждали небольшим денежным окладом. Средний подьячий получал несколько больший оклад. Подьячий мог выслужиться до старшего подьячего, которому полагалось годовое денежное жалованье.
Средний подьячий получал несколько больший оклад. Подьячий мог выслужиться до старшего подьячего, которому полагалось годовое денежное жалованье.
Составление и оформление приказов
Специалисты по управлению считают, что эффективность работы предприятия на 75% зависит от формализованного администрирования, т. е. от умения грамотно составлять инструкции, приказы и контролировать их исполнение.
Для того чтобы приказ был действенным, он должен содержать как минимум три основных элемента по каждому пункту приказа, а именно: что надо сделать, за какое время и кто из сотрудников за это отвечает.
Большинство руководителей не придерживаются данных прописных истин, поэтому часто в приказах отсутствует то срок исполнения, то исполнитель. В одной туристической фирме на обозрение сотрудников и клиентов был выставлен приказ: “Для улучшения обслуживания клиентов приказываем выполнять все этапы качественно”. Руководитель другой фирмы, побывав за границей, решил ввести правила одежды на работе в соответствии с западными стандартами. Приказ за его подписью звучал так: “Для повышения культуры труда обязываю всех сотрудников придерживаться корпоративного стиля одежды”. Но это требование руководителя осталось без ответа. Во-первых, сотрудникам никто не объяснил, что считает руководитель “корпоративным стилем одежды”. Во-вторых, в приказе не оговариваются сроки перехода на данный стиль и ответственное лицо, следящее за исполнением.
Руководитель другой фирмы, побывав за границей, решил ввести правила одежды на работе в соответствии с западными стандартами. Приказ за его подписью звучал так: “Для повышения культуры труда обязываю всех сотрудников придерживаться корпоративного стиля одежды”. Но это требование руководителя осталось без ответа. Во-первых, сотрудникам никто не объяснил, что считает руководитель “корпоративным стилем одежды”. Во-вторых, в приказе не оговариваются сроки перехода на данный стиль и ответственное лицо, следящее за исполнением.
Различают три вида приказа:
- приказ по административно-хозяйственным вопросам;
- приказ по основной деятельности;
- приказ по личному составу.
Рассмотрим методику составления приказа по основной деятельности.
Приказы по основной деятельности являются правовыми нормативными актами, реализующими управляемость объектов сверху вниз, т. е. от управляющего органа к управляемому.
Подготовка приказа включает в себя несколько этапов:
- инициирование издания приказа;
- сбор необходимой информации;
- подготовка проекта документа;
- согласование;
- проверка правильности оформления;
- подписание;
- доведение приказа до исполнителей.
Обработка распорядительных документов может регламентироваться положением о порядке подготовки и вступления в силу распорядительных документов организации или введением соответствующего раздела в инструкцию по делопроизводству организации.
Текст приказа состоит из двух взаимосвязанных частей: констатирующей и распорядительной. В констатирующей части указываются причины, послужившие основанием для издания приказа. Обычно данная часть начинается со следующих устойчивых словосочетаний: “В целях…”, “На основании…”, “В связи с…”.
Если основанием для издания приказа является какой-либо нормативный акт вышестоящего органа, то в констатирующей части следует указать вид акта, его автора, полное название (заголовок), номер и дату, т. е. приводятся все поисковые данные. Если нет необходимости давать разъяснения, то констатирующая часть может отсутствовать.
е. приводятся все поисковые данные. Если нет необходимости давать разъяснения, то констатирующая часть может отсутствовать.
Распорядительная часть отделяется от констатирующей глаголом “Приказываю”, который пишется прописными буквами с новой строки, без абзаца и кавычек, в конце глагола ставится двоеточие. Распорядительная часть делится на пункты и подпункты, которые нумеруются арабскими цифрами. В каждом пункте распорядительной части указываются исполнитель, предписываемое действие и срок исполнения. В качестве исполнителей могут выступать как отдельные должностные лица, так и организации. Количество исполнителей по каждому пункту не ограничено. Исполнитель указывается в дательном падеже. Например: “Директорам заводов…”, “Начальнику отдела кадров Иванову В. П…” и т. п. Предписываемое действие выражается глаголами в неопределенной форме “подготовить”, “зачислить”, “обеспечить”, “утвердить”. Срок исполнения должен быть реальным, соответствовать объему предлагаемых работ. Обычно устанавливается отдельный срок исполнения для каждого задания. Последним пунктом в приказах указывается лицо, на которое возлагается контроль за исполнением документа (должность и Ф. И.О.). Распорядительные документы могут иметь приложения, на которые даются ссылки в соответствующих пунктах распорядительной части. Однако реквизит “приложение” в данном случае не оформляется, ссылки на приложения даются в скобках в соответствующих пунктах. Например: “Утвердить инструкцию по делопроизводству” (приложение 1).
Последним пунктом в приказах указывается лицо, на которое возлагается контроль за исполнением документа (должность и Ф. И.О.). Распорядительные документы могут иметь приложения, на которые даются ссылки в соответствующих пунктах распорядительной части. Однако реквизит “приложение” в данном случае не оформляется, ссылки на приложения даются в скобках в соответствующих пунктах. Например: “Утвердить инструкцию по делопроизводству” (приложение 1).
На самом приложении в правом верхнем углу первого листа печатается слово “Приложение” (если приложений несколько, они нумеруются) и указывается, к какому приказу или пункту приказа относится приложение, например:
Словарь кадрового делопроизводства. Приказ – правовой акт, издаваемый руководителем органа управления, действующего на основе единоначалия для обеспечения основной и оперативной деятельности.
Приложение к приказу – дополнительные к основному тексту приказа материалы справочного, документационного или иного характера.
Если приложением к приказу является утверждаемый документ (положение, правила, инструкция и т. п.), в соответствующем пункте распорядительной части делается отметка: “(прилагается)”, а на приложении в верхнем правом углу размещается гриф утверждения документа.
В проектах приказов, имеющих одно или несколько приложений, должна быть единая нумерация страниц с охватом основного текста и всех приложений.
Приложения к проектам приказов должны визироваться исполнителем, подготовившим их, руководителями структурных подразделений. К проекту приказа прилагается список на рассылку.
Приказ оформляется на общем бланке формата А4. Далее в ходе работы над проектом приказа следуют этапы согласования и подписания. Проекты приказов, подготовленные для согласования, оформляются на стандартных листах бумаги с нанесением всех необходимых реквизитов и указанием на верхнем поле документа справа – “Проект”.
Проект до подписания подлежит согласованию со всеми заинтересованными лицами, а также со структурными подразделениями и должностными лицами, которых он касается. Согласование осуществляется путем визирования. Визы или гриф согласования, как правило, проставляются на первом экземпляре проекта. В случае несогласия с проектом пишут мотивированное заключение. Перед подписанием проект тщательно выверяется на наличие орфографических или стилистических ошибок. Приказ подписывается руководителем или заместителем руководителя предприятия.
Согласование осуществляется путем визирования. Визы или гриф согласования, как правило, проставляются на первом экземпляре проекта. В случае несогласия с проектом пишут мотивированное заключение. Перед подписанием проект тщательно выверяется на наличие орфографических или стилистических ошибок. Приказ подписывается руководителем или заместителем руководителя предприятия.
Пример составления приказа с угловым расположением реквизитов.
Для ознакомления с приказом могут быть подготовлены выписки из приказа по каждому пункту.
Приказ по административно-хозяйственной деятельности оформляется так же, как и приказ по основной деятельности.
Приведем еще один пример оформления приказа по основной деятельности, затрагивающего вопросы кадровой службы.
Работодатель должен организовать правильное и своевременное ведение трудовых книжек, а ответственность за ведение, хранение, учет и выдачу трудовых книжке несет специально уполномоченное лицо, назначаемое приказом (распоряжением) работодателя. Издание такого приказа по основной деятельности обязательно, несмотря на то что обязанности по работе с трудовыми книжками всегда включаются в должностные инструкции и в трудовые договоры работников, ответственных за работу с трудовыми книжками. В связи с периодической сменой работников кадровой службы, а также их возможным временным отсутствием представляется нежелательным указывать в тексте приказа о назначении ответственного за работу с трудовыми книжками фамилию работающего в настоящий момент сотрудника и можно ограничиться названием должности (если за ней закреплена одна штатная единица).
Издание такого приказа по основной деятельности обязательно, несмотря на то что обязанности по работе с трудовыми книжками всегда включаются в должностные инструкции и в трудовые договоры работников, ответственных за работу с трудовыми книжками. В связи с периодической сменой работников кадровой службы, а также их возможным временным отсутствием представляется нежелательным указывать в тексте приказа о назначении ответственного за работу с трудовыми книжками фамилию работающего в настоящий момент сотрудника и можно ограничиться названием должности (если за ней закреплена одна штатная единица).
Приказы по личному составу составляют отдельную группу кадровой документации и требуют определенных правил составления, отличных от приказов по основной деятельности. Они фиксируют прием на работу. перемещение по работе, увольнение с работы, установление должностных окладов, отпуска, командировки, изменение фамилии, поощрения, взыскания и т. д.
д.
В настоящее время действуют унифицированные формы большинства приказов по личному составу (Постановление Госкомстата России от 05.01.2004 N 1). Они имеют особенности составления и оформления: эти приказы оформляются не на несколько действий, а на одно, т. е. самостоятельно издается приказ о приеме на работу, самостоятельно о переводе, увольнении, командировании. Каждый приказ можно оформлять не на отдельного сотрудника, а сразу на несколько, что при большом количестве работающих очень удобно.
Введение унифицированных форм вызвало самые различные мнения: одни считают, что такие формы удобны и необходимы кадровой службе, другие полагают, что новые формы повышают трудоемкость работы по ведению кадровой документации.
Однако следует учитывать, что современной документации по кадрам присущи такие недостатки, как: неприспособленность некоторых документов к обработке средствами электронно-вычислительной техники, неоправданное разнообразие форм, оформляющих аналогичные задачи по организации управления кадрами, отсутствие единого нормативного документа по оформлению кадровой документации.
Разработчики унифицированных форм кадровой документации преследовали две цели: упорядочить и унифицировать традиционный комплекс документов, оформляющих ряд задач по организации управления кадрами и приспособить эти документы к компьютерной обработке.
Введение унифицированных форм приказов по личному составу позволило внести единообразие в структуру текста документа и избавило сотрудников кадровой службы от сомнений в выборе того или иного варианта написания распорядительной части.
В связи с тем что унифицированные формы разработаны не на все приказы по личному составу, рассмотрим общие особенности оформления приказов по личному составу, не вошедших в перечень унифицированных форм.
Оформление приказов по личному составу не имеет четких указаний ГОСТа на оформление распорядительной документации (ГОСТ Р 6.30-2003 “УСД. УСОРД. Требования к оформлению документов”), однако в целях внесения единообразия при составлении данного вида документа необходимо придерживаться ряда правил, которые оговариваются в инструкциях по организации работы с документами в конкретной организации.
Приказы по личному составу оформляются на бланках формата А4 и имеют следующий состав реквизитов:
- наименование организации – автора документа;
- наименование вида документа – “Приказ”;
- дата, номер;
- место издания, заголовок к тексту;
- текст;
- подпись;
- визы согласования;
- отметка об ознакомлении с приказом работника;
- отметка об исполнении документа и направлении его в дело.
Нумеруются приказы в течение календарного года. Номер (индекс) пишут с буквой “к”, что значит приказ по кадрам, или л/с (приказ по личному составу), возможны и другие буквенные обозначения. Главное, помнить – приказы с разными сроками хранения не могут формироваться в одно дело. Приказы визируют обычно заместитель директора по кадрам, сотрудник отдела кадров, начальник отдела, в который направляется работник, а приказы, имеющие пункт о материальной ответственности, обязательно визирует бухгалтер. Работник, ведущий кадровую документацию, должен ознакомить каждого сотрудника с приказом, после чего сотрудник проставляет свою визу, состоящую из следующих элементов: “С приказом ознакомлен”, подпись, расшифровка подписи и дата ознакомления.
Приказы вступают в силу с момента их подписания, но иногда в тексте приказа может быть указана другая дата вступления его в юридическую силу. Например, приказ подписан 22 апреля, а назначение работника на должность произведено 27 апреля.
К текстам приказа по личному составу предъявляются особые требования: формулировки должны быть четкими, точными, так как они отражают трудовые права работника. Приказ по личному составу в отличие от приказа по основной деятельности может не содержать констатирующую часть и распорядительное слово “Приказываю” (оно не содержится в приказах по личному составу в отличие от приказа по основной деятельности). Распорядительным словом в приказах по личному составу являются слова: “Принять”, “Уволить”, “Назначить”, “Изменить”, “Присвоить” и т. д.
Текст приказа, в связи со сложившейся практикой, может быть оформлен двумя способами.
Первый вариант, когда распорядительная часть обычно начинается с глагола: “Изменить”, “Присвоить”, “Объявить” и т. д., напечатанного прописными буквами без абзаца с новой строки после заголовка к тексту. Заголовок к тексту приказов отвечает на вопрос “о чем?”: о приеме, об увольнении, об изменении фамилии, об объявлении выговора, о переводе на другую работу и т. п. Далее, с новой строки, с абзаца пишутся полностью фамилия, имя, отчество сотрудника, на которого издается приказ и распространяется действие приказа.
д., напечатанного прописными буквами без абзаца с новой строки после заголовка к тексту. Заголовок к тексту приказов отвечает на вопрос “о чем?”: о приеме, об увольнении, об изменении фамилии, об объявлении выговора, о переводе на другую работу и т. п. Далее, с новой строки, с абзаца пишутся полностью фамилия, имя, отчество сотрудника, на которого издается приказ и распространяется действие приказа.
Пример:
Объявить:
Ивановой Ирине Сергеевне, старшему эксперту отдела продаж, выговор за
халатное отношение к служебным обязанностям, повлекшее порчу
технического оборудования.
Во втором варианте распорядительное слово пишут в одной строке с действием. Рассмотрим составление приказа о внесении изменений в документы, содержащие персональные данные работника, в связи с вступлением сотрудника в брак. Данный приказ не имеет унифицированной формы и оформляется по правилам оформления распорядительных документов. В тексте такого приказа обязательно должны содержаться сведения как о старых, так и о новых данных работника, реквизиты документов, на основании которых вносятся новые сведения о нем. Рекомендуемое название такого приказа – “Приказ о внесении изменений в документы, содержащие персональные данные работника”.
В тексте такого приказа обязательно должны содержаться сведения как о старых, так и о новых данных работника, реквизиты документов, на основании которых вносятся новые сведения о нем. Рекомендуемое название такого приказа – “Приказ о внесении изменений в документы, содержащие персональные данные работника”.
Образец приказа О внесении изменений в документы, содержащие персональные данные работника
Не рекомендуется использовать распространенную формулировку вроде “С такого-то числа считать Иванову Лебедевой в связи с регистрацией брака…”, т. к. это неграмотно. Можно подумать, что без приказа работодателя Иванова не будет считаться Лебедевой? Лебедевой она считается на основании свидетельства о регистрации брака, а не на основании приказа своего работодателя.
Неправильной является и другая распространенная формулировка – “Внести изменения в персональные данные работника”. Изменять персональные данные работника – это полномочие специальных государственных органов, а не кадровой службы работодателя. Кадровая служба лишь вносит изменения в документы, содержащие персональные данные, на основании документов об изменении персональных данных работников, выданных специальными государственными органами.
Кадровая служба лишь вносит изменения в документы, содержащие персональные данные, на основании документов об изменении персональных данных работников, выданных специальными государственными органами.
Дата составления приказа – поступление копии паспорта в кадровую службу.
Регистрация и хранение приказовПриказ о внесении изменений в документы, содержащие персональные данные, регистрируется в соответствующем журнале регистрации приказов.
С приказом о внесении изменений в документы, содержащие персональные данные, знакомят под роспись всех заинтересованных лиц: самого работника, соответствующих работников кадровой службы и бухгалтерии.
На основании такого приказа будут вноситься изменения в трудовую книжку работника, личную карточку работника, лицевой счет работника и иные документы отдела кадров, бухгалтерии, службы безопасности и иных структурных подразделений.
Приказы по основной деятельности имеют срок хранения “постоянно”. Приказы по административно-хозяйственным вопросам – срок хранения 5 лет.
Приказы по административно-хозяйственным вопросам – срок хранения 5 лет.
Приказы по личному составу о приеме, увольнении, перемещении сотрудников хранятся 75 лет. Однако приказы о предоставлении учебных отпусков, дежурств, взысканиях, краткосрочных внутри России командировках имеют срок хранения 5 лет в соответствии со ст. 6 Перечня типовых управленческих документов, образующихся в деятельности организации, с указанием сроков хранения. Располагаются приказы в деле по порядковым номерам приказов.
Библиография
1. Государственная система документационного обеспечения управления (ГСДОУ). Главархив. 1991.
2. ГОСТ Р 6.30-2003. “УСД. УСОРД. Требования к оформлению документов”. М.: Росархив; ВНИИДАД, 2003.
3. Доронина Л. А. Организация документооборота: Учебно-методическое пособие. М.: ГУУ, 2005.
4. Перечень типовых управленческих документов, образующихся в деятельности организации, с указанием сроков хранения. М.: Росархив; ВНИИДАД, 2002.
Л. Доронина К. э. н., Доцент, Заместитель директора Института информационных Систем управления ГУУ
э. н., Доцент, Заместитель директора Института информационных Систем управления ГУУ
Подписано в печать 20.06.2010 “Кадровик. Кадровое делопроизводство”, 2010, N 7
унифицированные формы приказов по личному составу
приказ об изменении фамилии работника образец
сроки хранения приказов по личному составу
приказ по личному составу образец
формы приказов по личному составу
книга регистрации приказов по основной деятельности
нумерация приказов на предприятии
формы приказов по предприятию
приказы по личному составу образец
журнал регистрации приказов по основной деятельности
срок хранения приказов по личному составу
как составить приказ
Приказы Министерства Здравоохранения РФ
Главная / Документы / Приказы Министерства Здравоохранения РФПриказ Министерства здравоохранения Российской Федерации от 15.04.2021 №354н
«Об утверждении порядка заключения и типовой формы соглашения о финансовом обеспечении мероприятий по организации дополнительного профессионального образования медицинских работников по программам повышения квалификации, а также по приобретению и проведению ремонта медицинского оборудования»
Приказ Министерства здравоохранения Российской Федерации от 26.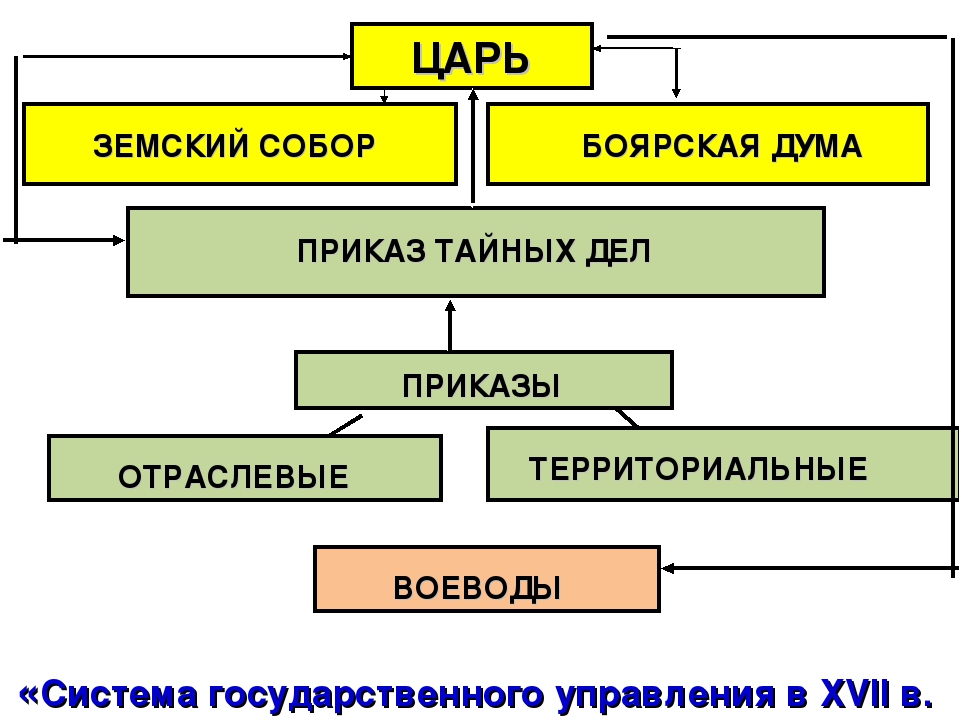 03.2021 №245н
03.2021 №245н
«Об утверждении порядка использования средств нормированного страхового запаса Федерального фонда обязательного медицинского страхования»
Приказ Министерства здравоохранения Российской Федерации от 15.03.2021 г. №205н
«Об утверждении Порядка выбора медицинским работником программы повышения квалификации в организации, осуществляющей образовательную деятельность, для направления на дополнительное профессиональное образование за счет средств нормированного страхового запаса Федерального фонда обязательного медицинского страхования, нормированного страхового запаса территориального фонда обязательного»
Приказ Министерства здравоохранения Российской Федерации от 19.02.2021 №116н
«Об утверждении Порядка оказания медицинской помощи взрослому населению при онкологических заболеваниях»
Приказ Министерства здравоохранения Российской Федерации от 12.02.2021 г. № 71н
«О внесении изменений в приказы Министерства здравоохранения Российской Федерации от 22 февраля 2019 г. № 85н «Об утверждении порядка формирования, условий предоставления медицинским организациям, указанным в части 66 статьи 26 Федерального закона «Об обязательном медицинском страховании в Российской Федерации», и порядка использования средств нормированного страхового запаса территориального фонда обязательного медицинского страхования для софинансирования расходов медицинских организаций на оплату труда врачей и среднего медицинского персонала» и от 22 февраля 2019 г. № 86н «Об утверждении типовой формы и порядка заключения соглашения о предоставлении медицинским организациям, указанным в части 66 статьи 26 Федерального закона «Об обязательном медицинском страховании в Российской Федерации», средств нормированного страхового запаса территориального фонда обязательного медицинского страхования для софинансирования расходов медицинских организаций на оплату труда врачей и среднего медицинского персонала»
№ 85н «Об утверждении порядка формирования, условий предоставления медицинским организациям, указанным в части 66 статьи 26 Федерального закона «Об обязательном медицинском страховании в Российской Федерации», и порядка использования средств нормированного страхового запаса территориального фонда обязательного медицинского страхования для софинансирования расходов медицинских организаций на оплату труда врачей и среднего медицинского персонала» и от 22 февраля 2019 г. № 86н «Об утверждении типовой формы и порядка заключения соглашения о предоставлении медицинским организациям, указанным в части 66 статьи 26 Федерального закона «Об обязательном медицинском страховании в Российской Федерации», средств нормированного страхового запаса территориального фонда обязательного медицинского страхования для софинансирования расходов медицинских организаций на оплату труда врачей и среднего медицинского персонала»
Приказ Министерства здравоохранения Российской Федерации от 05. 02.2021 № 57н
02.2021 № 57н
«Об определении видов медицинских организаций, которым предоставляются средства нормированного страхового запаса территориального фонда обязательного медицинского страхования на цели, указанные в пункте 4 части 6 статьи 26 Федерального закона от 29 ноября 2010 г. № 326-ФЗ «Об обязательном медицинском страховании в Российской Федерации», и видов оказываемой ими медицинской помощи в целях предоставления указанных средств»
Требования к структуре и содержанию тарифного соглашения, утвержденные приказом Министерства здравоохранения Российской Федерации от 29.12.2020 № 1397н
Приказ Министерства здравоохранения Российской Федерации от 23.12.2020 № 1363н
Приказ Министерства здравоохранения Российской Федерации от 7 июля 2020 г. № 682н
Приказ Министерства здравоохранения Российской Федерации от 23.12.2019 № 1074н
“Об утверждении доли заработной платы в структуре среднего норматива финансовых затрат на единицу объема высокотехнологичной медицинской помощи, не включенной в базовую программу обязательного медицинского страхования, а также формы представления органами, осуществляющими функции и полномочия учредителей, информации о показателях объема высокотехнологичной медицинской помощи, не включенной в базовую программу обязательного медицинского страхования, установленных для государственных учреждений в государственном задании, на год, предшествующий году, на который рассчитывается субсидия”
Приказ Министерства здравоохранения Российской Федерации от 21 января 2020 г. № 39н
№ 39н
О внесении изменений в приложения № 1 и 2 к Приказу Министерства здравоохранения Российской Федерации от 22 февраля 2019 г. № 85н «Об утверждении порядка формирования, условий предоставления медицинским организациям, указанным в части 6/6 статьи 26 Федерального закона «Об обязательном медицинском страховании в Российской Федерации», и порядка использования средств нормированного страхового запаса территориального фонда обязательного медицинского страхования для софинансирования расходов медицинских организаций на оплату труда врачей и среднего медицинского персонала».
Методические рекомендации «Новая модель медицинской организации, оказывающей первичную медико-санитарную помощь»
Методические рекомендации «Новая модель медицинской организации, оказывающей первичную медико-санитарную помощь», утвержденные Министерством здравоохранения РФ от 30.07.2019 г.
Приказ Министерства здравоохранения Российской Федерации от 28 января 2019 г. № 25н
№ 25н
«Об утверждении порядка и сроков рассмотрения тарифных соглашений, заключаемых в соответствии с частью 2 статьи 30 Федерального закона от 29 ноября 2010 г. № 326-ФЗ «Об обязательном медицинском страховании в Российской Федерации», подготовки заключения Федеральным фондом обязательного медицинского страхования о соответствии тарифного соглашения базовой программе обязательного медицинского страхования и его типовой формы»
Приказ Министерства здравоохранения Российской Федерации от 22 февраля 2019 г. № 86н
Об утверждении типовой формы и порядка заключения соглашения о предоставлении медицинским организациям, указанным в части 6.6 статьи 26 Федерального закона «Об обязательном медицинском страховании в Российской Федерации», средств нормированного страхового запаса территориального фонда обязательного медицинского страхования для софинансирования расходов медицинских организаций на оплату труда врачей и среднего медицинского персонала
Приказ Министерства здравоохранения Российской Федерации от 22 февраля 2019 г. № 85н
№ 85н
Приказ Министерства здравоохранения Российской Федерации от 28 февраля 2019 г. № 108н
“Об утверждении Правил обязательного медицинского страхования”
Отзыв информационно – методического письма Министерства здравоохранения РФ от 26 февраля 2018г. № 15-4/682-07
Приказ Министерства здравоохранения Российской Федерации от 13 марта 2019 № 124н
“Об утверждении порядка проведения профилактического медицинского осмотра и диспансеризации определенных групп взрослого населения”
Приказ Министерства здравоохранения Российской Федерации от 10 мая 2017 года № 203н
“Об утверждении критериев оценки качества медицинской помощи”
Приказ Министерства здравоохранения Российской Федерации от 29 июня 2016 года № 425н
“Об утверждении Порядка ознакомления пациента либо его законного представителя с медицинской документацией, отражающей состояние здоровья пациента”
Акушерско-гинекологическая помощь женскому населению
 08.2021
08.2021Документ (DOCX, 131Kb) 31.08.2021
Документ (DOCX, 127Kb) 23.08.2021
Файл (PDF, 2Mb) 22.07.2021
Документ (DOCX, 101Kb) 30.03.2021
Документ (DOCX, 103Kb) 19.03.2021
Файл (PDF, 761Kb) 16.02.2021
Файл (PDF, 204Kb) 22.01.2021
Файл (PDF, 6Mb) 13.01.2021
Документ (DOCX, 730Kb) 10.12.2020
Документ (DOCX, 13Kb) 03.09.2020
Файл (PDF, 133Kb) 22.07.2020
Файл (PDF, 795Kb) 23.08.2019
Файл (PDF, 5Mb) 23.08.2019
Файл (PDF, 396Kb) 09.07.2019
Файл (PDF, 563Kb) 09.07.2019
Файл (PDF, 21Mb) 09.07.2019
Файл (PDF, 455Kb) 09.07.2019
Файл (PDF, 1Mb) 28.05.2019
Файл (PDF, 205Kb) 15.01.2019
Файл (PDF, 10Mb) 14.12.2018
Пензенский государственный аграрный университет – Главная
Расписание
Очное ОтделениеБакалавриат
Агрономический факультет
Агрохимия и агропочвоведение
1 курс 2 курс 3 курс 4 курсАгрономия
1 курс 2 курс
3 курс 4 курс
Землеустройство и кадастры
1 курс 2 курс 3 курс 4 курсЛесное дело
1 курс 2 курс
3 курс 4 курс
Инженерный факультет
Агроинженерия
1 курс 2 курс 3 курс 4 курсЭксплуатация транспортно-технологических
машин и комплексов
1 курс 2 курс
3 курс 4 курс
Технологический Факультет
(Б) Зоотехния
1 курс 2 курс 3 курс 4 курсТехнология производства и переработки
с/х продукции
Ветеринарно-санитарная экспертиза
1 курс 2 курс 3 курс 4 курсЭкономический факультет
Менеджмент
1 курс 2 курс
3 курс 4 курс
Экономика
1 курс 2 курс 3 курс 4 курсСпециалитет
Технологический Факультет
Ветеринария
1 курс 2 курс
3 курс 4 курс
Экономический факультет
Экономическая безопасность
1 курс 2 курс
3 курс 4 курс
5 курс
Инженерный факультет
Наземные транспортно-технологические средства
1 курс 2 курс
Магистратура
Агрономический факультет
Агрохимия и агропочвоведение1 курс 2 курс
Инженерный факультет
Агроинженерия, Эксплуатациятранспортно-технологических
машин и комплексов
1 курс 2 курс
Технологический Факультет
Зоотехния
1 курс 2 курс
Экономический факультет
Экономика
1 курс 2 курс
Аспирантура
Агрономический факультет
1 курс 2 курс
3 курс
Инженерный факультет
1 курс 2 курс
Технологический Факультет
1 курс 2 курс
Среднее профессиональное
образование
Факультет СПО
На базе основного общего образования
1 курс 2 курс
3 курс 4 курс
На базе среднего общего образования
1 курс 2 курс
3 курс
Очно-заочное ОтделениеСпециалитет
Технологический Факультет
Ветеринария
1 курс 2 курс
3 курс 4 курс
Бакалавриат, специалитет
Агрономический факультет
1 курс 2 курс
3 курс 4 курс
5 курс
Технологический факультет
1 курс 2 курс
3 курс 4 курс
5 курс
Инженерный факультет
1 курс 2 курс
3 курс 4 курс
5 курс
Экономический факультет
1 курс 2 курс
3 курс 4 курс
5 курс 6 курс
Магистратура
Агрономический факультет
1 курс 2 курс
Технологический факультет
1 курс 2 курс
Инженерный факультет
1 курс 2 курс
Экономический факультет
1 курс 2 курс
Аспирантура
Экономический факультет
1 курс 2 курс
Территориальная сеть
На территории Пермского края функции по организации единой системы государственного кадастрового учета недвижимости, государственной регистрации прав на недвижимое имущество и сделок с ним, инфраструктуры пространственных данных, землеустройства, государственного мониторинга земель, геодезии и картографии, наименований географических объектов, а также функции по федеральному государственному надзору в области геодезии и картографии, государственному земельному надзору, надзору за деятельностью саморегулируемых организаций оценщиков, контролю деятельности саморегулируемых организаций арбитражных управляющих осуществляет Управление Федеральной службы государственной регистрации, кадастра и картографии по Пермскому краю (Управление Росреестра по Пермскому краю).
Функции органа кадастрового учета на территории региона осуществляет филиал Федерального государственного бюджетного учреждения «Федеральная кадастровая палата Федеральной службы государственной регистрации, кадастра и картографии» по Пермскому краю (филиал ФГБУ «ФКП Росреестра» по Пермскому краю). Основной задачей филиала является ведение и предоставление сведений из государственного кадастра недвижимости на территории края. Филиал также реализует полномочия Росреестра в Пермском крае по оказанию государственных услуг в сфере предоставления сведений из Единого государственного реестра прав на недвижимое имущество и сделок с ним и приема-выдачи документов по регистрации прав и сделок с недвижимостью.
Положение об Управлении Росреестра по Пермскому краю (приказ Росреестра от 30.05.2016 № П/0263)
Положение об Управлении Росреестра по Пермскому краю (приказ Росреестра от 23.01.2017 № П 0027)
РЕЕСТР действующих Соглашений (договоров) Управления Росреестра по Пермскому краю
Политика Управления Федеральной службы государственной регистрации кадастра и картографии по Пермскому краю в отношении обработки персональных данных
Официальная группа Управления Росреестра по Пермскому краю в социальной сети «Вконтакте»
Официальная группа Управления Росреестра по Пермскому краю в социальной сети «Инстаграм»
Контакты
Адрес: 614990, г. Пермь, ул. Ленина, д. 66/2
Телефон: 8 (342) 205-95-59, «телефон доверия» по вопросам противодействия коррупции (342) 205-96-82
Контактный e-mail: [email protected]
Руководство
Аржевитина Лариса Владимировна – руководитель Управления Росреестра по Пермскому краю
Дальневосточный государственный гуманитарно-технический колледж – Дальневосточный государственный гуманитарно-технический колледж
Дальневосточный государственный гуманитарно-технический колледж производит набор
на очную и заочную форму обучения на бюджетной и договорной основе по следующим специальностям:
ДВГГТК сегодня — это уникальное образовательное учреждение, обладающее современной материально-технической базой и квалифицированным преподавательским составом для качественной подготовки специалистов по девяти специальностям среднего профессионального образования, которые являются востребованными на рынке труда Приморского края и за его пределами.
В колледже обучается более 1600 студентов, для которых созданы все условия для успешного получения образования, творческого роста, обеспечения безопасного и здорового образа жизни. Для студентов действуют учебные кабинеты, учебно-производственные мастерские, центр малярных и декоративных работ, центр подготовки сварщиков, центр пожарно-спасательной подготовки, учебно-тренировочный тренажер “Скалодром”, три спортивных зала, в которых работает 10 спортивных секций (волейбол, баскетбол, мини-футбол, настольный теннис, пейнтбол, бокс, греко-римская борьба, смешанные единоборства ММА, самбо, корпус спасателей), актовый зал, библиотека и читальный зал с компьютерами для самоподготовки студентов к занятиям, буфет, благоустроенное общежитие. Для успешной адаптации студентов к учебному процессу в колледже создан институт кураторства.
В рамках Молодежного центра созданы вокальный и танцевальный кружки, волонтерское движение «Восток-VT», студенческий строительный отряд БАМ, штаб подготовки и проведения творческих мероприятий, литературное объединение «Вдохновение», агитбригада, студенческий мини-театр.
Студентам, успешно обучающимся на бюджетной основе по очной форме обучения, выплачиваются академическая и социальная стипендии.
Структура белков высшего порядка
При разработке белков для использования в качестве биопрепаратов первичная структура (аминокислотная последовательность) важна для определения активности белка. Из-за сложной природы белковых препаратов важно охарактеризовать структуру белка высшего порядка (HOS), чтобы понять его стабильность, укладку, структуру и функциональную активность.
Структура белка может быть охарактеризована на разных уровнях:
- Структура первичного порядка
Последовательность аминокислот в полипептидной цепи.Первичная последовательность белка определяет его структуру и функцию. - Вторичная структура заказа
Сюда входят локализованные структуры внутри белкового остова. Наиболее распространенными типами вторичных структур являются α-спираль и β-складчатый лист, удерживаемый водородными связями. - Третичная структура заказа
Трехмерная форма белка. - Структура четвертичного порядка
Это структура мультибелкового комплекса, такого как димер или тример.
Вторичную, третичную и четвертичную структуру часто называют структурой более высокого порядка (HOS) белка. HOS отвечает за правильное складывание и трехмерную форму биологического препарата. На это могут повлиять различные составы, которые, в свою очередь, могут повлиять на активность белка. Сворачивание и форма белка напрямую влияют на функциональность белкового лекарственного средства.
Подходит ли для моего приложения структура высшего порядка?
Неправильная структура более высокого порядка также может вызвать проблемы с безопасностью – если общая укладка и, следовательно, трехмерная форма белка неверны, могут быть обнаружены иммуногенные эпитопы и может произойти агрегация белка.Характеристика HOS является критическим компонентом разработки биологических препаратов и должна выполняться наряду с функциональным анализом и характеристикой первичной структуры, чтобы обеспечить полное понимание общей структуры белка.
HOS характеризуется множеством наших биофизических решений, включая:
- Масс-спектрометрия (MS)
- Круговой дихроизм (CD)
- Инфракрасная спектроскопия с преобразованием Фурье (FTIR)
- Рамановская спектроскопия Рентгеновская кристаллография Ядерный магнитный резонанс (ЯМР)
- CD в ближнем УФ-диапазоне
- ВЭЖХ с вытеснением по размеру и SEC-MALS
- Флуоресценция
- Статическое и динамическое светорассеяние (SLS и DLS)
- Дифференциальная сканирующая калориметрия (DSC)
- Аналитическое ультрафугирование AUC)
С помощью дополнительных и ортогональных методов данные HOS можно использовать для принятия решений о том, какие препараты следует развивать в рамках разработки, как составлять препараты и / или в качестве исследований контроля качества и биосовместимости.
Какие решения для более высокой структуры заказов (HOS) предлагает Malvern Panalytical?
Несколько инструментов в нашем наборе инструментов для характеризации используются для определения характеристик HOS биопрепаратов, в том числе: автоматические системы MicroCal PEAQ DSC и PEAQ-DSC, серия светорассеивающих инструментов Zetasizer и OMNISEC для эксклюзионной хроматографии (SEC), включая SEC- Мальчики.
Структура белков вторичного, третичного и более высокого порядка
Два основных типа вторичной структуры , которые следует учитывать, – это α-спираль и ß-лист .Α-Спираль представляет собой правостороннюю спиральную нить с водородными связями между спиралями, что делает структуру очень стабильной. ß-листы состоят из межнитевых водородных связей с парами связанных прядей, лежащих бок о бок.
Круговой дихроизм измеряет различия в поглощении света с левой и правой круговой поляризацией. Ученые BioPharmaSpec используют тот факт, что α-спирали и β-листы имеют определенные профили CD, и используют изменения в этих спектрах для оценки образцов и определения наличия каких-либо структурных изменений.
Вторичная структура может быть определена с помощью спектроскопии КД в спектральной области « дальний УФ » (190–250 нм). На этих длинах волн хромофор представляет собой пептидную связь , и сигнал возникает, когда он находится в правильной, свернутой среде. Каждая из α-спиральных, β-листовых и случайных катушечных структур дает характерный спектр КД. Таким образом, приблизительная доля каждого типа вторичной структуры, которая присутствует в любом белке, может быть определена путем деконволюции данных и сравнения с базой данных структуры белков с использованием таких алгоритмов, как CDsstr.
Измерение КД в «ближнем УФ-диапазоне » (> 250 нм) генерирует отпечаток КД третичной структуры биомолекул . На отпечаток пальца влияет природа окружающей среды ароматических боковых цепей аминокислот триптофана , фенилаланина и тирозина . Наличие дисульфидных связей также может повлиять на окончательный отпечаток пальца.
Данные КД в дальнем УФ-диапазоне, полученные в результате анализа RMP (зеленый) и биоподобного (серый) моноклонального антитела.Результаты, полученные при оценке исходных данных с использованием базы данных структуры белков и алгоритма CDSSTR, представлены в виде таблицы.
Структура высшего порядка 2021 – CASSS
9-й Международный симпозиум по структуре белковой терапии высшего порядка
Спасибо всем, кто присутствовал, за успех HOS 2021! Увидимся в следующем году 4-6 апреля 2022 года в Гейтерсбурге, штат Мэриленд!
Введение
Структура высшего порядка белка (HOS) включает вторичные, третичные и четвертичные структуры белка, которые включают трехмерные структуры, необходимые для структуры и функционирования.Белки в растворе представляют собой динамические молекулы, которые могут создавать образцы ансамбля структур в растворе и обладают молекулярными свойствами, что приводит к разной склонности к самоассоциации и формированию ряда разновидностей от олигомеров до видимых частиц. Изменения в HOS белков могут способствовать качественным характеристикам и потенциально безопасности, эффективности и фармакокинетическим свойствам терапевтических белков. Регулирующие органы требуют оценки HOS, чтобы оценить, как белок на структуру влияют изготовление, хранение и доставка; а аналитическое биоподобие – важная часть оценки потенциальных изменений клинической безопасности и эффективности.Существует множество методов биофизической характеристики и инструменты, используемые для мониторинга свойств белковых терапевтических средств, таких как конформация и структура более высокого порядка. Однако, поскольку большинство биофизических анализов предоставляют среднюю по ансамблю структурную информацию о молекулах, это важно для оценки того, являются ли наблюдаемые изменения значительными и отслеживают ли изменения в CQA и не могут быть отнесены на счет анализа или изменчивости процесса. Использование соответствующего биофизического метода, разработка метода и квалификация Таким образом, характеристика атрибутов качества на разных этапах жизненного цикла продукта является предметом интереса и обсуждения для широкого круга аудиторий.Этот симпозиум будет посвящен различным биофизическим методам оценки. белков HOS, а также применения соответствующих инструментов на различных этапах разработки белковых терапевтических средств и оценок биоподобия, теории и практики биофизики, технических данных из академических кругов. и отрасль, а также квалификация методов, валидация и установочные спецификации.
Основные докладчики:
Дарья Мочли-Розен, Стэнфордский университет и Марина Фещенко, Biogen
Темы будут включать следующее:
• HOS в разработке I и II
• Биологические последствия HOS
• Круглые столы в новом интерактивном формате
• Открытие и отбор кандидатов
• Исследователь нового поколения
• Основы и установленные методы
• Новые технологии
• Поздняя ломка
• Возможности нетворкинга в частном порядке с партнерами и сообществом CASSS
Мы не можем дождаться встречи с вами на HOS 2021!
Хотите больше информации? Ознакомьтесь с раскрывающимся списком «Еще в этом разделе» вверху страницы!
Или свяжитесь с CASSS по телефону 510-428-0740 или casss @ casss.org
Определение структуры белка более высокого порядка путем быстрого фотохимического окисления белков и масс-спектрометрического анализа
Анфинсен, CB, Haber, E., Sela, M. & White, FH Кинетика образования нативной рибонуклеазы при окислении восстановленная полипептидная цепь. Proc. Natl Acad. Sci. США 47 , 1309–1314 (1961).
CAS PubMed Google ученый
Дрент Дж. Принципы рентгеновской кристаллографии белков (Springer Science & Business Media, 2007).
Вютрих К. Путь к ЯМР-структурам белков. Nat. Struct. Биол. 8 , 923–925 (2001).
PubMed Google ученый
Макферсон А. Введение в кристаллизацию белков. Методы 34 , 254–265 (2004).
CAS PubMed Google ученый
Cheng, Y. КриоЭМ одиночных частиц с кристаллографическим разрешением. Cell 161 , 450–457 (2015).
CAS PubMed PubMed Central Google ученый
Бай, X.-c, Макмаллан, Г. и Шерес, С. Х. У. Как крио-ЭМ революционизирует структурную биологию. Trends Biochem. Sci. 40 , 49–57 (2015).
CAS PubMed Google ученый
Merk, A. et al. Преодоление барьеров разрешения крио-ЭМ для облегчения открытия лекарств. Ячейка 165 , 1698–1707 (2016).
CAS PubMed PubMed Central Google ученый
Гринфилд, Н. Дж. Использование спектров кругового дихроизма для оценки вторичной структуры белка. Nat. Prot. 1 , 2876–2890 (2006).
CAS Google ученый
Нобл, Дж. Э. и Бейли, М. Дж. А. в журнале Methods in Enzymology, Vol. 463 (ред. Берджесс, Р. Р. и Дойчер, М. П.) Гл. 8 73–95 (Academic Press, 2009).
Kong, J. & Yu, S. Инфракрасный спектроскопический анализ с преобразованием Фурье вторичных структур белков. Acta Biochim. Биофиз. Грех. 39 , 549–559 (2007).
CAS PubMed Google ученый
Stetefeld, J., Маккенна, С. А. и Патель, Т. Р. Динамическое рассеяние света: практическое руководство и приложения в биомедицинских науках. Biophys. Ред. 8 , 409–427 (2016).
CAS PubMed PubMed Central Google ученый
Данчик В., Аддона Т. А., Клаузер К. Р., Ват, Дж. Э. и Певзнер П. А. Секвенирование пептидов De novo с помощью тандемной масс-спектрометрии. J. Comput. Биол. 6 , 327–342 (1999).
PubMed Google ученый
Витце, Э. С., Олд, В. М., Ресинг, К. А. и Ан, Н. Г. Картирование посттрансляционных модификаций белков с помощью масс-спектрометрии. Nat. Методы 4 , 798–806 (2007).
CAS PubMed Google ученый
Лю, X. Р., Чжан, М. М. и Гросс, М. Л. Масс-спектрометрический след белков для анализа структуры более высокого порядка: основы и приложения. Chem. Ред. 120 , 4335–4454 (2020).
Google ученый
Mendoza, V. L. & Vachet, R. W. Исследование структуры белка с помощью ковалентного мечения, специфичного для аминокислот, и масс-спектрометрии. Масс-спектрометр. Ред. 28 , 785–815 (2009).
CAS PubMed PubMed Central Google ученый
Конерманн, Л., Пан, Дж. И Лю, Й.-Х. Водородообменная масс-спектрометрия для изучения структуры и динамики белков. Chem. Soc. Ред. 40 , 1224–1234 (2011).
CAS PubMed Google ученый
Малекния, С. Д. и Даунард, К. М. Достижения масс-спектрометрии с радикальными зондами для определения следа белков в приложениях химической биологии. Chem. Soc. Ред. 43 , 3244–3258 (2014).
CAS PubMed Google ученый
Болла, Дж. Р., Агасид, М. Т., Мехмуд, С. и Робинсон, С. В. Мембранные белок-липидные взаимодействия, исследованные с помощью масс-спектрометрии. Annu. Rev. Biochem. 88 , 85–111 (2019).
CAS PubMed Google ученый
Xu, G. & Chance, M. R. Модификация белков, опосредованная гидроксильными радикалами, в качестве зондов для структурной протеомики. Chem. Ред. 107 , 3514–3543 (2007).
CAS PubMed Google ученый
Kaur, U. et al. Эволюция структурной биологии через призму масс-спектрометрии. Анал. Chem. 91 , 142–155 (2019).
CAS PubMed Google ученый
Эрнандес, Х. и Робинсон, К. В. Определение стехиометрии и взаимодействий макромолекулярных сборок с помощью масс-спектрометрии. Nat. Prot. 2 , 715 (2007).
Google ученый
Бенеш, Дж. Л. П., Руотоло, Б. Т., Симмонс, Д. А., Робинсон, К. В. Белковые комплексы в газовой фазе: технология структурной геномики и протеомики. Chem. Ред. 107 , 3544–3567 (2007).
CAS PubMed Google ученый
Синц А. Химическое сшивание и масс-спектрометрия для картирования трехмерных белковых структур и белок-белковых взаимодействий. Масс-спектрометр. Ред. 25 , 663–682 (2006).
CAS PubMed Google ученый
Uetrecht, C., Rose, R.J., van Duijn, E., Lorenzen, K. & Heck, A. J. R. Масс-спектрометрия ионной подвижности белков и белковых ансамблей. Chem. Soc. Ред. 39 , 1633–1655 (2010).
CAS PubMed Google ученый
Zhang, M. M. et al.Интегрированный подход к определению границы связывания белок-белок в растворе и оценке кинетики обмена водород-дейтерий для оценки кандидатов моделей стыковки. Анал. Chem. 91 , 15709–15717 (2019).
CAS PubMed Google ученый
Zhang, M. M. et al. Картирование эпитопов и паратопов PD-1 / ниволумаба с помощью масс-спектрометрии на основе обмена водорода и дейтерия, сшивания и молекулярного стыковки. Анал. Chem. 92 , 9086–9094 (2020).
CAS PubMed Google ученый
Kelleher, N. L. et al. Сравнение белков сверху вниз и снизу вверх с помощью тандемной масс-спектрометрии высокого разрешения. J. Am. Chem. Soc. 121 , 806–812 (1999).
CAS Google ученый
Эспино, Дж. А. и Джонс, Л.М. Освещение биологических взаимодействий со следами белков in vivo. Анал. Chem. 91 , 6577–6584 (2019).
CAS PubMed PubMed Central Google ученый
West, G. M. et al. Подход количественной протеомики для идентификации взаимодействий белок-лекарство в сложных смесях с использованием измерений стабильности белка. Proc. Natl Acad. Sci. США 107 , 9078–9082 (2010).
CAS PubMed Google ученый
Джин, Л., Ван, Д., Гуден, Д. М., Болл, К. Х. и Фицджеральд, М. С. Подход, основанный на целевой масс-спектрометрии, для анализа связывания белок-лиганд в сложных биологических смесях с использованием стратегии модификации фенацилбромида. Анал. Chem. 88 , 10987–10993 (2016).
CAS PubMed Google ученый
Катта В., Чайт Б. Т. и Карр С. Конформационные изменения в белках, исследованные с помощью масс-спектрометрии с электрораспылением и ионизацией водородом. Rapid Commun. Масс-спектрометрия. 5 , 214–217 (1991).
CAS PubMed Google ученый
Чжан З. и Смит Д. Л. Определение амидного водородного обмена с помощью масс-спектрометрии: новый инструмент для выяснения структуры белков. Protein Sci. 2 , 522–531 (1993).
CAS PubMed PubMed Central Google ученый
Энгландер, С. В. и Калленбах, Н. Р. Водородный обмен и структурная динамика белков и нуклеиновых кислот. Q. Rev. Biophys. 16 , 521–655 (1983).
CAS PubMed Google ученый
Schanda, P. & Brutscher, B.Очень быстрая двумерная ЯМР-спектроскопия для исследования динамических событий в белках в реальном времени в масштабе секунд. J. Am. Chem. Soc. 127 , 8014–8015 (2005).
CAS PubMed Google ученый
Уэльс, Т. Э. и Энген, Дж. Р. Водородообменная масс-спектрометрия для анализа динамики белков. Масс-спектрометр. Ред. 25 , 158–170 (2006).
CAS PubMed Google ученый
Энген, Дж. Р. Анализ конформации и динамики белков с помощью масс-спектрометрии водород / дейтерий. Анал. Chem. 81 , 7870–7875 (2009).
CAS PubMed PubMed Central Google ученый
Андерсон, К. В., Галлахер, Э. С. и Хадженс, Дж. У. Автоматическое удаление фосфолипидов из мембранных белков для рабочих процессов масс-спектрометрии с обменом h / d. Анал. Chem. 90 , 6409–6412 (2018).
CAS PubMed PubMed Central Google ученый
Möller, I. R. et al. Улучшение покрытия последовательности интегральных мембранных белков во время масс-спектрометрических экспериментов с обменом водород / дейтерий. Анал. Chem. 91 , 10970–10978 (2019).
PubMed Google ученый
Jensen, P. F. et al. Удаление N-связанных гликозилирований при кислом pH с помощью PNGase A облегчает масс-спектрометрический анализ обмена водорода / дейтерия N-связанных гликопротеинов. Анал. Chem. 88 , 12479–12488 (2016).
CAS PubMed Google ученый
Zhang, J.-G., Reid, G.E., Moritz, R.L., Ward, L.D. и Simpson, R.J. Специфическая ковалентная модификация остатков триптофана в мышином интерлейкине-6. Eur. J. Biochem. 217 , 55–59 (1993).
Google ученый
Лю Т., Marcinko, T. M., Kiefer, P. A. & Vachet, R. W. Использование ковалентного мечения и масс-спектрометрии для изучения сайтов связывания белков в молекулах, ингибирующих амилоид. Анал. Chem. 89 , 11583–11591 (2017).
CAS PubMed PubMed Central Google ученый
Ли, К. С., Ши, Л. и Гросс, М. Л. Быстрое фотохимическое окисление белков (FPOP) на основе масс-спектрометрии для характеристики структуры более высокого порядка. В соотв. Chem. Res. 51 , 736–744 (2018).
CAS PubMed PubMed Central Google ученый
Maleknia, S. D., Brenowitz, M. & Chance, M. R. Миллисекундная радиолитическая модификация пептидов с помощью синхротронного рентгеновского излучения, идентифицированного с помощью масс-спектрометрии. Анал. Chem. 71 , 3965–3973 (1999).
CAS PubMed Google ученый
Хэмбли, Д. М. и Гросс, М. Л. Фотолиз перекиси водорода с помощью лазерной вспышки для окисления остатков белков, доступных растворителю, в микросекундной шкале времени. J. Am. Soc. Масс-спектрометрия. 16 , 2057–2063 (2005).
CAS PubMed Google ученый
Li, J. et al. Картирование энергетического эпитопа взаимодействия антитела / интерлейкина-23 с обменом водород / дейтерий, масс-спектрометрией быстрого фотохимического окисления белков и мутагенезом аланинового бритья. Анал. Chem. 89 , 2250–2258 (2017).
CAS PubMed PubMed Central Google ученый
Джонс, Л. М., Б. Сперри, Дж., А. Кэрролл, Дж. И Гросс, М. Л. Быстрое фотохимическое окисление белков для картирования эпитопов. Анал. Chem. 83 , 7657–7661 (2011).
CAS PubMed PubMed Central Google ученый
Stocks, B. B. и Konermann, L. Структурная характеристика короткоживущих промежуточных продуктов разворачивания белков с помощью лазерно-индуцированного окислительного мечения и масс-спектрометрии. Анал. Chem. 81 , 20–27 (2009).
CAS PubMed Google ученый
Чен, Дж., Ремпель, Д. Л. и Гросс, М. Л. Скачок температуры и быстрое фотохимическое окисление зонд субмиллисекундного сворачивания белка. J. Am. Chem.Soc. 132 , 15502–15504 (2010).
CAS PubMed PubMed Central Google ученый
Чен, Дж., Ремпель, Д. Л., Гау, Б. К. и Гросс, М. Л. Быстрое фотохимическое окисление белков и масс-спектрометрия следуют за субмиллисекундным сворачиванием белка на аминокислотном уровне. J. Am. Chem. Soc. 134 , 18724–18731 (2012).
CAS PubMed PubMed Central Google ученый
Ли, К. С., Ремпель, Д. Л. и Гросс, М. Л. Конформационно-чувствительное быстрое фотохимическое окисление белков и масс-спектрометрия характеризуют агрегацию бета-амилоида 1–42. J. Am. Chem. Soc. 138 , 12090–12098 (2016).
CAS PubMed PubMed Central Google ученый
Лю, X. Р., Чжан, М. М., Ремпель, Д. Л. и Гросс, М. Л. Взаимодействие белка с лигандом путем титрования лигандов, быстрого фотохимического окисления белков и масс-спектрометрии: LITPOMS. J. Am. Soc. Масс-спектрометрия. 30 , 213–217 (2019).
CAS PubMed Google ученый
Лю, X. Р., Чжан, М. М., Ремпель, Д. Л. и Гросс, М. Л. Единый подход позволяет выявить сложные конформационные изменения, порядок связывания и сродство связывания кальция с кальмодулином. Анал. Chem. 91 , 5508–5512 (2019).
CAS PubMed PubMed Central Google ученый
Лю, X. Р., Ремпель, Д. Л. и Гросс, М. Л. Составные конформационные изменения сигнальных белков при связывании лиганда, выявленные с помощью единого подхода: исследование кальций-кальмодулин. Анал. Chem. 91 , 12560–12567 (2019).
CAS PubMed PubMed Central Google ученый
Эспино, Дж. А., Мали, В. С. и Джонс, Л. М. Поступление следов клеток в сочетании с масс-спектрометрией для структурного анализа белков в живых клетках. Анал. Chem. 87 , 7971–7978 (2015).
CAS PubMed Google ученый
Апрахамян, М. Л., Чеа, Э., Джонс, Л. М. и Линдерт, С. Прогнозирование структуры белка Розетты по данным масс-спектрометрии с отпечатками гидроксильных радикалов. Анал. Chem. 90 , 7721–7729 (2018).
CAS PubMed PubMed Central Google ученый
Апрахамян М. Л. и Линдерт С. Использование данных масс-спектрометрии ковалентного мечения в предсказании структуры белка с помощью Rosetta. J. Chem. Теория вычисл. 15 , 3410–3424 (2019).
CAS PubMed PubMed Central Google ученый
Cheng, M., Zhang, B., Cui, W. & Gross, M. L. Инициированное лазером радикальное трифторметилирование пептидов и белков: приложение к основанному на масс-спектрометрии белковому следу. Angew. Chem. Int. Эд. 56 , 14007–14010 (2017).
CAS Google ученый
Чжан М. М., Ремпель Д. Л. и Гросс М. Л. Платформа быстрого фотохимического окисления белков (FPOP) для свободнорадикальных реакций: анион-радикал карбоната с пептидами и белками. Free Radic. Биол. Med. 131 , 126–132 (2019).
CAS PubMed Google ученый
Чжан Б., Ремпель Д. Л. и Гросс М. Л. Следы белков карбенами на платформе быстрого фотохимического окисления белков (FPOP). Am. Soc. Масс-спектрометрия. 27 , 552–555 (2016).
CAS Google ученый
Лю, X. Р., Чжан, М. М., Чжан, Б., Ремпель, Д. Л. и Гросс, М. Л. Пути гидроксил-радикальных реакций для быстрого фотохимического окисления платформы белков, что выявлено изотопным мечением 18O. Анал. Chem. 91 , 9238–9245 (2019).
CAS PubMed PubMed Central Google ученый
Вайс, Д. А., Гросс, М. Л. и Пакраси, Х. Б. Активные формы кислорода оставляют след повреждения, который открывает водные каналы в Фотосистеме II. Sci. Adv. 3 , eaao3013 (2017).
PubMed PubMed Central Google ученый
Heyduk, E. & Heyduk, T. Картирование белковых доменов, участвующих в макромолекулярных взаимодействиях: новый подход к белковым следам. Биохимия 33 , 9643–9650 (1994).
CAS PubMed Google ученый
Шарп, Дж. С., Беккер, Дж. М. и Хеттич, Р. Л. Анализ поверхностей, доступных для белкового растворителя, с помощью фотохимического окисления и масс-спектрометрии. Анал. Chem. 76 , 672–683 (2004).
CAS PubMed Google ученый
Ай, Т. Т., Лоу, Т. Ю. и Сзе, С. К. Наносекундный лазерно-индуцированный метод фотохимического окисления для картирования поверхности белков с помощью масс-спектрометрии. Анал. Chem. 77 , 5814–5822 (2005).
CAS PubMed Google ученый
Yan, Y. et al. Быстрое фотохимическое окисление белков (FPOP) отображает эпитоп связывания egfr с аднектином. J. Am. Soc. Масс-спектрометрия. 25 , 2084–2092 (2014).
CAS PubMed PubMed Central Google ученый
Чжан, Х., Гау, Б. К., Джонс, Л. М., Видавский, И. и Гросс, М. Л. Быстрое фотохимическое окисление белков для сравнения структур комплексов белок-лиганд: модельная система кальмодулин-пептид. Анал. Chem. 83 , 311–318 (2011).
CAS PubMed Google ученый
Zhang, Y., Rempel, D. L., Zhang, H. & Gross, M. L. Усовершенствованная платформа для быстрого фотохимического окисления белков (FPOP) для белковой терапии. J. Am. Soc. Масс-спектрометрия. 26 , 526–529 (2015).
CAS PubMed Google ученый
Гаррисон, У. М. Реакционные механизмы при радиолизе пептидов, полипептидов и белков. Chem. Ред. 87 , 381–398 (1987).
CAS Google ученый
Чен, Дж., Цуй, В., Гиблин, Д. и Гросс, М. Л. Новый след белков: быстрое фотохимическое йодирование в сочетании с масс-спектрометрией сверху вниз и снизу вверх. J. Am. Soc. Масс-спектрометрия. 23 , 1306–1318 (2012).
CAS PubMed PubMed Central Google ученый
Manzi, L. et al. Карбеновый футпринт точно отображает сайты связывания во взаимодействиях белок-лиганд и белок-белок. Nat. Commun. 7 , 13288 (2016).
CAS PubMed PubMed Central Google ученый
Хэмбли Д. М. и Гросс М. Л. Холодное химическое окисление белков. Анал. Chem. 81 , 7235–7242 (2009).
CAS PubMed PubMed Central Google ученый
Гау, Б. К., Шарп, Дж. С., Ремпель, Д.Л. и Гросс, М. Л. Быстрое фотохимическое окисление белковых следов быстрее, чем разворачивание белков. Анал. Chem. 81 , 6563–6571 (2009).
CAS PubMed PubMed Central Google ученый
Srikanth, R., Wilson, J. & Vachet, R. W. Правильная идентификация окисленных остатков гистидина с использованием диссоциации с переносом электрона. J. Mass Spectrom. 44 , 755–762 (2009).
CAS PubMed PubMed Central Google ученый
Li, X., Li, Z., Xie, B. & Sharp, J. S. Улучшенная идентификация и относительная количественная оценка сайтов окисления пептидов и белков для определения следа гидроксильных радикалов. J. Am. Soc. Масс-спектрометрия. 24 , 1767–1776 (2013).
CAS PubMed Google ученый
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки вашего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Методы на основе масс-спектрометрии для характеристики структуры высшего порядка белковых терапевтических средств
Основные моменты
- •
Структура белковых терапевтических средств высшего порядка является важным атрибутом качества, который определяет как эффективность, так и безопасность этих лекарств.
- •
Ряд современных инструментов экспериментальной биофизики (например, ЯМР и рентгеновская кристаллография) плохо подходят для рутинного анализа и определения характеристик биофармацевтических продуктов.
- •
Масс-спектрометрия позволяет охарактеризовать структуру более высокого порядка биофармацевтических препаратов, столь же сложных, как моноклональные антитела, на беспрецедентном уровне детализации и уже стала неотъемлемой частью аналитического инструментария в биофармацевтике.
Реферат
Белковая терапевтическая структура высшего порядка является важным атрибутом качества, который определяет как эффективность, так и безопасность. Хотя современная экспериментальная биофизика предлагает впечатляющий арсенал современных инструментов, которые можно использовать для характеристики структур более высокого порядка, многие из них плохо подходят для характеристики биофармацевтических продуктов. В результате эти анализы традиционно проводились с использованием классических методов, обеспечивающих относительно низкую информативность.За последнее десятилетие масс-спектрометрия дебютировала в этой области, что позволило охарактеризовать структуру более высокого порядка биофармацевтических препаратов, столь же сложных, как моноклональные антитела, на уровне детализации, который ранее был недостижим. В настоящее время масс-спектрометрия является неотъемлемой частью аналитического инструментария во всей отрасли, что имеет решающее значение не только для усилий по контролю качества, но также для открытий и разработок.
Ключевые слова
Биофармацевтический анализ
Конформация
Развертывание
Тепловой стресс
Агрегация
Конформационная динамика
Обмен водорода / дейтерия
Нативная масс-спектрометрия
статьи полный текст Эльзевьер Б.V. Все права защищены.Рекомендуемые статьи
Цитирующие статьи
Анализ структуры высшего порядка моноклональных антител с помощью высокопроизводительного конформационного массива белков
РЕФЕРАТ
Выявление структуры высшего порядка антител (HOS) имеет решающее значение в разработке терапевтических антител. Поскольку HOS определяет биоактивность и химиофизические свойства белка, эти знания могут помочь гарантировать, что атрибуты безопасности и эффективности не будут нарушены.Конформационный массив белков (PCA) – это новый метод определения HOS моноклональных антител. Ранее мы успешно использовали иммуноферментный анализ (ELISA) на основе PCA вместе с другими биоаналитическими инструментами для выяснения структуры агрегатов антител. В этом исследовании, применяя новый PCA на основе мультиплексирования с пропускной способностью в 48 раз выше, чем на основе ELISA, мы выявили структурные различия между различными молекулами антител и изменения структуры антител, затронутые различными условиями обработки.Анализ молекул антител методом PCA четко продемонстрировал значительные различия между подклассами IgG1 и IgG4 в отношении воздействия эпитопа и статуса сворачивания. Кроме того, мы применили малоугловое рассеяние рентгеновских лучей для расшифровки механистических представлений о технологии PCA и проверки структурной информации, полученной с помощью PCA. Эти данные улучшают наше фундаментальное понимание HOS mAb в целом. Анализ PCA образцов антител из различных условий обработки также показал, что агрегация антител вызвала значительно более высокое воздействие эпитопов антител, что потенциально привело к появлению «чужеродной» молекулы, которая могла бы вызвать иммуногенность.Данные PCA хорошо коррелировали с результатами стабильности белка, полученными традиционными методами, такими как эксклюзионная хроматография и анализ теплового сдвига белка. Наше исследование продемонстрировало, что PCA с высокой пропускной способностью является подходящим методом для анализа HOS при открытии и разработке терапевтических антител.
КЛЮЧЕВЫЕ СЛОВА: Моноклональные антитела, Высокая пропускная способность, Конформационный массив белков, Структура высшего порядка, Разработка биопрепаратов
Введение
В целом, белковые терапевтические препараты, содержащие моноклональные антитела (mAb), значительно выросли за последние двадцать лет. 1-3 Широко известно, что трехмерная (3D) конформация антитела влияет на его биологические функции. 4-6 Понимание взаимосвязей между структурой и активностью и роли структуры высшего порядка (HOS) в механизме действия терапевтических белков необходимо для определения и контроля важнейших характеристик качества продукта. 7 Регулирующие органы возлагают все большие надежды на определение характеристик биопрепаратов методом HOS для контроля качества и устанавливают особенно высокую планку для биоподобных продуктов. 8-11 Определение или мониторинг конформационных изменений mAb в разработке предлагает глубокое понимание влияния условий процесса на качество белка и может привести к дальнейшему улучшению продукта и производительности процесса.
Общие методы структурной характеристики, такие как ядерный магнитный резонанс (ЯМР), рентгеновская кристаллография, круговой дихроизм (КД) и масс-спектрометрия (МС), имеют различные ограничения при применении к разработке биопрепаратов. ЯМР и рентгеновские лучи могут предоставить структурную информацию с разрешением на атомном уровне, но для получения подходящей структурной информации требуется специальная обработка образцов или подготовка, такая как мечение изотопов или кристаллизация. 10 , 12-14 Длительные периоды сбора данных и доступность инструментов еще больше ограничивают их применение в промышленной среде. CD может предоставлять вторичную или третичную структурную информацию в зависимости от используемого диапазона длин волн. 15 Сложные буферные матрицы в образцах, созданных в процессе проявления, могут иметь сильное поглощение в ближнем или дальнем УФ-диапазоне, что ограничивает применение КД в разработке биопрепаратов. Кроме того, сигнал CD представляет собой сумму всего mAb, и поэтому трудно определить, какая часть белка вносит вклад в изменения сигнала CD.МС, особенно МС с водородно-дейтериевым обменом (HDX-MS), может конкретно определить, где происходят изменения конформации. Однако МС является дорогостоящим, малопроизводительным и трудоемким методом, поэтому он не подходит для применения в разработке биопрепаратов. 16-18
Метод конформационного массива белков (PCA) был недавно разработан для получения информации о HOS для mAb при разработке терапевтических антител. 19 , 20 Его использовали для анализа конформационных вариантов и определения структурного сходства между биоаналогом и его эталонным продуктом, 21 , 22 , но его также можно использовать при разработке новых терапевтических антител.В методе PCA был разработан набор из 34 захватывающих антител (pAb1-pAb34) для связывания 34 фрагментов IgG, соответственно, из продаваемого антитела. Для общего набора захватывающих антител, используемых для разработки новых mAb, захватывающие антитела для константной области основаны на аминокислотной последовательности трастузумаба (Герцептин®), включая pAb13-pAb34. Каждая из вариабельных областей-мишеней pAb1-pAb12, и они используются как равная смесь 7 различных захватывающих антител, нацеленных на одно и то же положение из 7 продаваемых mAb.Эта стратегия объединенных антител продемонстрировала хорошую чувствительность и охват по отношению к новым mAb, находящимся в стадии разработки. 34 фрагмента IgG, используемых в качестве антигенов для генерации захватывающих антител, являются последовательными, с небольшим перекрытием, чтобы покрыть всю последовательность антитела IgG. Когда интересующее антитело IgG хорошо свернуто, эти 34 фрагмента имеют ограниченную доступность или отсутствие доступа для 34 соответствующих захватывающих антител из-за их относительного положения и ориентации в mAb и, таким образом, очень слабо взаимодействуют или не взаимодействуют с этими захватывающими антителами.Неполное сворачивание или частичное разворачивание IgG обеспечивает большую доступность фрагментов IgG и более сильное взаимодействие с захватывающими антителами. Следовательно, сила взаимодействия между захватывающими антителами и представляющими интерес антителами IgG становится индикатором статуса укладки IgG и локальной доступности каждого фрагмента IgG. Полный набор данных о доступности для 34 фрагментов вместе с интересующим IgG предоставляет информацию о HOS для IgG.
Сэндвич-твердофазный иммуноферментный анализ (ELISA) был разработан путем иммобилизации 34 захватывающих антител на 34 отдельных лунках планшета для захвата каждого фрагмента IgG на интересующем mAb. 16 , 17 С помощью этого анализа можно определить как степень, так и место конформационного изменения. Результаты очень хорошо коррелировали с результатами HDX MS в нашем недавнем исследовании. 13 Однако этот метод является трудоемким, поскольку для одного образца IgG требуется не менее 34 лунок. В коммерческом наборе из трех 96-луночных планшетов можно использовать только три образца в двух экземплярах с одним контролем. Недавно был разработан новый высокопроизводительный метод, объединяющий эти 34 улавливающих антитела с технологией мультиплексирования Luminex.Вместо иммобилизации 34 захватывающих антител в 34 отдельных лунках, эти антитела иммобилизованы на 34 различных магнитных шариках, которые имеют цветовую кодировку и могут быть смешаны вместе для захвата 34 фрагментов IgG в одной лунке. По сравнению с методом ELISA, этот метод мультиплексирования значительно увеличивает производительность в 48 раз, поскольку один 96-луночный планшет может тестировать 48 образцов в двух экземплярах, что более применимо для поддержки анализа HOS большого объема образцов при разработке биопрепаратов.
В этой работе мы продемонстрировали применение этого нового высокопроизводительного анализа PCA для поддержки разработки новых mAb.Мы расшифровали механистическое понимание структуры mAb, выявленное с помощью PCA, с использованием малоуглового рассеяния рентгеновских лучей (SAXS) и коррелировали информацию о структуре, полученную с помощью PCA, с информацией о стабильности белка, полученной с помощью эксклюзионной хроматографии (SEC) и анализа теплового сдвига белка (PTS). . Наше исследование показало, что высокопроизводительный PCA очень эффективен для: 1) сравнения структурных различий между разными молекулами IgG; 2) определение стабильности mAb в различных буферах и мониторинг изменений структуры в процессе; и 3) оценка воздействия на конструкции различных условий.Следовательно, этот метод можно использовать для скрининга mAb на раннем этапе обнаружения на предмет возможности разработки и производства, а также для изучения структурной сопоставимости во время изменений клеточной линии или процесса, которые происходят на разных клинических фазах. Кроме того, этот PCA может предоставлять информацию о конкретной региональной структуре с высокой пропускной способностью. 16 Структурные данные, полученные с помощью PCA, обеспечивают глубокое понимание продукта и процесса для поддержки разработки mAb как для биоподобных, так и для новых mAb. Насколько нам известно, это первый отчет об анализе HOS на антитела с использованием мультиплексной высокопроизводительной PCA.
Обсуждение
Структурные различия IgG1 и IgG4
На сегодняшний день IgG1 и IgG4 являются преобладающими подклассами IgG терапевтических mAb, одобренных в США и Европейском Союзе (68 из 77). 23 Хотя IgG1 и IgG4 имеют большое сходство последовательностей, они имеют существенно разные свойства, что можно объяснить структурными различиями. Наше исследование демонстрирует, что PCA – чувствительный и надежный метод, который может четко идентифицировать конформационные различия между IgG1 и IgG4.Мы также использовали ортогональный метод, малоугловое рентгеновское рассеяние, чтобы охарактеризовать структурные различия IgG1 и IgG4, который установил сильную корреляцию с результатами PCA.
В подклассах IgG IgG1 и IgG4 высоко консервативны, но различаются шарнирными областями и верхними доменами Ch3. Эти области участвуют в связывании как с рецепторами Fcγ (FcγR), так и с C1q. Различие в этих областях между IgG1 и IgG4 приводит к разному периоду полужизни и эффекторным функциям, таким как фагоцитоз, антителозависимая клеточно-опосредованная цитотоксичность и активация комплемента. 24 , 25 Эти функциональные различия объясняются структурными различиями. Уровень сигнала PCA отражает доступность 34 фрагментов IgG, захваченных соответствующим общим набором из 34 мАт. Менее свернутые IgG будут больше подвергать эпитопы захватывающим антителам и производить более сильный сигнал, и наоборот. Следовательно, сигнал PCA подразумевает статус сворачивания интересующего IgG. Значительная разница в сигнале PCA между IgG1 и IgG4 предполагает, что mAb IgG1 укладывается сильнее, чем mAb IgG4, что приводит к меньшей экспозиции областей в IgG1.Общий сигнал PCA исследуемых mAb прямо пропорционален площади поверхности, доступной для растворителя (SASA), рассчитанной с использованием моделей гомологии, подобранных SAXS (). Чем выше SASA из-за меньшего сворачивания, тем выше сигнал PCA для этой молекулы IgG. Тенденция сигнала PCA также коррелирует с радиусом инерции, Dmax и молекулярным объемом этих молекул IgG (Таблица S-1), что дополнительно подтверждает статус сворачивания. Эти результаты предполагают, что PCA можно использовать для эффективного мониторинга и сравнения общего статуса укладки различных молекул IgG.
(A) Строили график зависимости полного сигнала PCA от площади поверхности, доступной для растворителя (SASA). Общая доступная для растворителя площадь поверхности была рассчитана с помощью моделей гомологии, как описано в разделе онлайн-методов. (B) Функция общего сигнала PCA была построена как функция температуры плавления различных mAb, определенных с помощью экспериментов по тепловому сдвигу белков. (C) Функция общего сигнала PCA была нанесена на график как функция HMW процентного содержания mAb5, определенного с помощью SEC-HPLC в различных условиях буфера.(мАт1: черный, мАт2: красный, мАт3: зеленый, мАт4: синий и мАт5: голубой).
Более гибкая структура (Fab и Fc) IgG4, чем IgG1, фундаментально поддерживается с двух точек зрения. Во-первых, IgG4 имеет более короткую шарнирную область, но на два остатка Pro в шарнирной области больше, чем IgG1. Это приводит к более жесткой шарнирной области для IgG4, что делает другие части молекулы (Fab и Fc) более гибкими во время броуновского движения. Во-вторых, дисульфидная связь между тяжелой и легкой цепями в IgG4 делает Fab более гибким.В IgG4 последний остаток Cys в легкой цепи каппа образует дисульфидную связь между тяжелой и легкой цепью с остатком Cys в середине домена Ch2, в результате чего один лист сэндвича Ch2 остается несвязанным. В IgG1 последний остаток Cys в легкой цепи каппа образует дисульфидную связь между тяжелой и легкой цепью с остатком Cys на конце домена Ch2, что оставляет домен Ch2 скрепленным вместе с доменом CL.
Корреляция информации о стабильности mAb между PCA, SEC и PTS
Разработка процесса очистки и рецептуры mAb требует различных буферов с различным pH, типом солености и концентрацией, что может отрицательно сказаться на стабильности белка и других характеристиках качества.В этом исследовании PCA успешно применялся для определения HOS mAb в различных условиях буферизации. Доступность 34 областей mAb, определенных с помощью PCA, влияет на стабильность mAb, которая хорошо коррелирует с информацией о стабильности, полученной с помощью SEC и теплового сдвига белка.
Было продемонстрировано, что агрегация белков является основным фактором иммуногенности биопрепаратов. 26 , 27 Чувствительное и систематическое измерение видов mAb HMW, включая агрегаты, должно предоставить ценную информацию во время разработки процесса.Высокий процент HMW показывает, что mAb5 менее стабильно в буферах 2, 6 и 10 (). Все эти три буфера имеют низкий pH (3,5) и высокую концентрацию соли (200 мМ NaCl). SEC – это стандартный метод HMW-характеристики терапевтических белков. Хотя SEC автоматизирован UPLC, пропускная способность не так высока, как у других методов, таких как PCA и PTS. PCA и PTS также могут предоставить дополнительную структурную информацию, как описано в следующих разделах.
Наши данные PCA для того же набора образцов предполагают, что mAb5 в буферах 2, 6 и 10 имеет более высокий сигнал и меньшую стабильность, что соответствует результатам анализа SEC.Кроме того, мы можем сказать, что мАт5 имеет более низкий сигнал в буферах 1, 5 и 9. Эти три буфера имеют низкий pH (3,5) без NaCl. Это говорит о том, что необычно высокое значение HMW при SEC и высокий сигнал PCA в буферах 2, 6 и 10 объясняется комбинированным эффектом как низкого pH (3,5), так и высокой концентрации соли (200 мМ). Кроме того, результаты PCA предполагают, что наиболее затронутые области, такие как 19, 20, 26, 28, 30 и 31, находятся близко к или внутри области Fc мАт5. Это может быть вызвано диссоциацией двух солевых мостиков между двумя цепями Ch3-Ch4 из-за индуцированного низким pH протонирования глутаминовой кислоты в солевом мостике. 28 , 29 Однако наше исследование показывает, что низкий pH сам по себе не вызывает большой агрегации. Скорее, добавление соли при низком pH может способствовать гидрофобным взаимодействиям между диссоциированным Fc из различных мономеров и вызывать высокую агрегацию. Агрегация белков известна как основная связанная с продуктом примесь, вызывающая иммуногенность; однако молекулярная основа белковых агрегатов, вызывающих иммуногенность, не выяснена. В этом исследовании было продемонстрировано, что агрегация mAb приводила к значительному увеличению воздействия эпитопа, как измерено с помощью PCA ().Таким образом, возможно, что это увеличенное воздействие нового эпитопа из-за образования агрегата может трансформировать mAb из «собственной» молекулы в «чужеродную» молекулу для иммунной системы человека, вызывая, таким образом, иммунный ответ. Поскольку PCA является более чувствительным и систематическим анализом статуса HOS mAb, этот результат также предполагает, что анализ PCA может быть использован для прогнозирования потенциала иммуногенности для mAb с детектируемыми агрегатами. Тестирование высвобождения цитокинов с использованием цельной крови человека для изучения возможной корреляции между mAb HOS и иммуногенностью продолжается. 30
PTS, также известный как дифференциальная сканирующая флуориметрия (DSF), был рутинным методом скрининга стабильности белков в различных условиях буфера. 31 Как показано на фиг.3, перед тем, как белок начнет плавиться, сигнал флуоресценции из анализа PCA (отражающий воздействие эпитопа) в буфере 2, 6 и 10 немного выше, чем в буфере 1. Этот более высокий сигнал флуоресценции указывает на частичное разворачивание агрегатов. mAb5 из-за низкого pH и высокого содержания соли (Таблица S-2).Во время переходной стадии высота переходного пика обратно пропорциональна процентному содержанию агрегата, что указывает на развертывание мономера. Наше исследование полноразмерных mAb5, mAb5 Fab и mAb5 Fc (рис. S-1) показывает, что первый пик приписывается плавлению домена mAb5 Fc. Таким образом, данные PTS предполагают, что домен Fc мАт5 более чувствителен к низкому pH и высокому содержанию соли, чем Fab мАт5. Индикация хорошо совпадает с результатами PCA, что сигналы pAb1-18 для Fab обычно ниже, чем сигналы pAb19-34 для Fc ().
Мониторинг конформационных изменений mAb при биопроцессинге
Рекомбинантные mAb претерпевают различные драматические изменения окружающей среды в процессе от предшествующей клеточной культуры до последующей очистки. 15 , 32 , 33 mAb могут изменять свою конформацию в ответ на эти изменения окружающей среды. Мы применили PCA для определения конформационных изменений mAb в процессе. Эти глубокие знания могут способствовать улучшению процесса и привести к более надежному процессу и контролю качества.
Одним из основных преимуществ PCA является его способность анализировать конформационные изменения без очистки белка из сложной среды, такой как культура клеток, поскольку примеси могут быть смыты после захвата белка антителами PCA. Наши данные предполагают, что конформация mAb5 существенно не изменяется во время культивирования клеток с дня H-6 до дня H (). Незначительные изменения во время процесса культивирования клеток происходят в середине mAb5, что позволяет предположить, что области, захваченные антителами 19 и 20, становятся менее подверженными воздействию после дня H-4, поскольку сигнал уменьшается с дня H-4 до дня H.Это может означать, что mAb5 претерпевает созревание сворачивания с Дня H-4 до Дня H. Интересно, что профили N-гликанов незначительно меняются в ходе культивирования клеток от Дня H-2 до Дня H. Учитывая фрагменты, захваченные антителом 19 и 20 находятся на конце домена Ch2 и близко к домену Ch3, где происходит модификация N-гликана, мы предполагаем, что изменения в областях, захваченных антителами 19 и 20, могут быть связаны с изменениями профиля N-гликанов во время клеточного культура. Однако вопрос о том, влияет ли N-гликан на конформацию этой области и каким образом, требует дальнейшего изучения и выходит за рамки данного исследования.
Белки изменяют свою третичную и четвертичную структуру в различных буферных матрицах. 34 В этом исследовании mAb5 подвергается взаимодействию со смолой и изменению буфера в последующем процессе. В нашем последующем процессе mAb5 столкнулось с аффинной элюцией связывания в хроматографии с протеином A, стадиями инактивации вируса с низким pH и нейтральным pH с более высокой концентрацией соли на стадиях полировки CEX и AEX. Наши данные показывают, что сигнал образца с этапа вирусной инактивации выше, чем у образцов с других этапов.Это говорит о том, что обработка с низким pH (pH 3,5 в течение 60 минут) при вирусной инактивации приводит к частичной денатурации mAb, обнажая скрытые области, захваченные исследуемыми антителами. mAb5 стабильно при pH 4,5 (PAE) в этом процессе, поскольку сигнал образца PAE незначительно или не превышает сигнал двух других нейтральных образцов (CEX и AEX). Эти области, такие как 19, 20, 26, 28, 30 и 31, с более высокими сигналами в образце VI, близки к домену Fc или внутри него. Это говорит о том, что область Fc более чувствительна к обработке с низким pH в последующем процессе.
В этом исследовании мы продемонстрировали широкое применение нового формата PCA с высокой пропускной способностью, включая сравнение HOS различных молекул mAb, анализ стабильности, связанной со структурой, в различных буферах и мониторинг изменения HOS в процессинге антител. Анализ PCA привел к важным результатам, в том числе к значительным различиям IgG1 и IgG4 в фолдинге и воздействии эпитопа, а также к пониманию агрегации антител на молекулярном уровне, которая потенциально может вызывать иммуногенность. Для фундаментального понимания и проверки этого метода мы выявили механистическое понимание конформационных различий IgG1 и IgG4, различаемых PCA со структурной характеристикой с использованием SAXS.Мы коррелировали информацию о HOS, полученную от PCA, со стабильностью IgG, проанализированной традиционными методами SEC и PTS. Одним из преимуществ PCA по сравнению с другими технологиями анализа HOS является его высокая чувствительность и способность реагировать на конкретные региональные изменения. Помимо предоставления общего структурного отпечатка для сравнения различных структурных изменений mAb или mAb, анализ PCA может привести к конкретным действиям, таким как реинжиниринг чувствительной области (ов) или оптимизация условий процесса и состава для минимизации изменений HOS, которые могут вызвать иммуногенность mAb или влияет на его эффективность.Мониторинг изменений структуры антител во время разработки процесса имеет важное значение для безопасности и эффективности конечного продукта. Формат PCA с высокой пропускной способностью обеспечивает его применимость для поддержки разработки антител. Наша работа внесла свой вклад в разработку нового высокопроизводительного метода для характеристики структуры mAb более высокого порядка, который обеспечивает глубокое понимание продукта и процесса, чтобы облегчить открытие и разработку mAb и гарантировать качество конечного продукта.
Материалы и методы
Химические вещества
Все химические вещества, использованные в данном исследовании, были получены от Sigma-Aldrich, если не указано иное.
Подготовка образца для конформационного массива белков
Все рекомбинантные терапевтические mAb (mAb1-6) были получены в Bristol-Myers Squibb с использованием системы экспрессии клеток млекопитающих. Исходная концентрация образца варьировалась от 10 мг / мл до 50 мг / мл. Все образцы доводили до концентрации 100 мкг / мл с использованием буфера для разведения перед использованием в PCA.
Во время культивирования клеток mAb5 в биореакторе объемом 5 л было собрано 15 мл образцов клеточной культуры в День H-6, H-4, H-2 и H (День сбора урожая).Образцы клеточных культур центрифугировали для удаления клеток и фильтровали с использованием фильтра 0,2 мкм. Титры образцов Н-6, Н-4, Н-2 и Н составляли 1,2, 1,8, 2,3 и 2,9 мг / мл соответственно. Все образцы были разбавлены до 100 мкг / мл с использованием буфера для разведения перед PCA.
Образцы mAb5 в последующем процессе собирали после PAE, VI, CEX и AEX. Концентрации образцов PAE, VI, CEX и AEX составляют 16,5, 16,2, 12,0 и 3,4 мг / мл соответственно. Все образцы были разбавлены до 100 мкг / мл с использованием буфера для разведения перед PCA.
Для исследования конформационных изменений и стабильности mAb5 в различных буферах, матрице буферов с различными типами буферных солей (трис, фосфат, цитрат, ацетат), концентрациями солей (с 200 мМ хлорида натрия и без него) и pH (3,5 -8,0) были приготовлены с использованием манипулятора для жидкости TECAN. MAb5 восстанавливали в этих различных буферах путем замены буфера с использованием колонок для обессоливания Sephadex G-25. Образцы mAb5 с замененным буфером инкубировали при комнатной температуре в течение 24 часов перед тем, как образцы были дополнительно проанализированы с использованием PCA, SEC и PTS.
Конформационный массив белков
PCA проводили с использованием набора MILLIPLEX InnoPlex Beta (MilliporeSigma). В наборе каждое из 34 антител было конъюгировано с индивидуальной цветной магнитной бусиной. Смесь цветных и конъюгированных с антителами магнитных шариков суспендировали и вносили аликвоты в 96-луночный планшет, поставляемый с набором. После инкубации при 4 ° C при встряхивании супернатант удаляли, а магнитные шарики удерживали в планшете для ELISA с помощью магнита. Все образцы белка перед использованием разбавляли до 100 мкг / мл с использованием буфера для разведения.100 мкл каждого образца белка добавляли в планшет для ELISA и инкубировали с конъюгированными с антителами магнитными шариками при 4 ° C при встряхивании. Не захваченные белки отбрасывали, а захваченные белки на шариках сохраняли в планшете для ELISA с использованием магнита. После сообщения о реакции антител, проявления цвета и остановки добавления раствора образцы были перенесены в канал с использованием системы Luminex MAGPIX, контролируемой Luminex xPonent. Магнитные шарики идентифицировали с использованием двух лучей декодирующего света, а захваченный белок на магнитных шариках детектировали с помощью флуоресценции.Данные были представлены с идентичностью этих 34 антител по оси абсцисс и интенсивностью флуоресценции, указывающей количество захваченного интересующего белка по оси ординат.
Эксклюзионная хроматография
Анализ SEC проводили в системе Waters Acquity UPLC с использованием колонки BHE SEC 200. При каждой инъекции в колонку вводили 10 мкг образца и использовали подвижную фазу 20 мМ фосфата калия, 200 мМ хлорида натрия, pH 6,8 для уравновешивания и элюирования. Сбор и анализ данных выполнялись в Empower 3.
Тепловой сдвиг белка
Стартовый набор для термического сдвига белка (Thermo Fisher Scientific) использовали для исследования термостабильности молекул IgG (мАт1-5) и стабильности мАт5 в различных буферах. Подготовка образцов проводилась в соответствии с руководством пользователя продавца с минимальными изменениями. Вкратце, краситель был предварительно разбавлен до 16Х красителя из 5000Х красителя с использованием белкового буфера термического сдвига. Все образцы белка разбавляли с использованием буфера для термического сдвига белков до 100 мкл исходного раствора при 0 ° С.2 мг / мл. Белковый буфер термического сдвига (5,0 мкл), основной раствор белка (12,5 мкл) и предварительно разведенный 16Х краситель (2,5 мкл) смешивали в 96-луночном планшете для ПЦР, причем каждый образец белка имел четыре повтора. После вращения планшета в настольной центрифуге, чтобы убедиться в отсутствии пузырьков воздуха в планшете для ПЦР, кривую плавления образцов собирали в приборе Vii A 7 QPCR с фильтром возбуждения 580 ± 10 нм и фильтром испускания 623 ± 10 нм и скорость изменения температуры 1 ° C / мин от 25 ° C до 99 ° C. Кривые плавления анализировали в программе Protein Thermal Shift ™ (V1.2).
Эксперименты SAXS и анализ трехмерной модели
Все мАт1-5 заменяли буфером на фосфатный буфер, содержащий 20 мМ фосфата натрия, 150 мМ хлорид натрия и pH 7,2, используя фильтры Amicon с отсечкой по молекулярной массе 30 кДа в соответствии с инструкциями производителя. Данные синхротронного МУРР были собраны на линии луча 16ID (LIX) в National Synchrotron Light Source II в Брукхейвенской национальной лаборатории (Аптон, Нью-Йорк). Образцы загружали с помощью самодельного автоматического пробоотборника.Рассеяние от растворов белка IgG с концентрацией 1 мг / мл измеряли при 4 ° C при передаче импульса до 2,0 Å -1 . Передача импульса определяется как Q = 4π sin (θ) / Λ, где θ – угол рассеяния, а Λ – длина волны рентгеновского излучения (Λ = 1,5 Å). Анализ данных проводился с использованием программного пакета ATSAS (V2.6). PRIMUS 35 был использован для построения графика Гинье и графика Карита. GNOM 36 использовался для создания распределения парных расстояний, а DAMMIN 37 использовался для создания 3D-моделей.SUPALM 38 использовали для подгонки моделей гомологии IgG к их моделям SAXS. Get Area использовали для анализа доступности фрагментов в Pymol для растворителей (V1.7, Schrödinger, LLC).
